- 2025年 景品表示法対応!米国BSCGによる品質認証サービス開始
株式会社RCTジャパンは、米国BSCG(Banned Substances Control Group)と提携し、健康食品、化粧品、ペットフード向けの新たな品質認証サービスを開始しました(2025年)。このサービスは、景品表示法に抵触することなく、「世界初」「日本初」といった表現を広告に用いるためのエビデンスを提供するものです。
近年、景品表示法の規制強化により、「No.1」「世界初」「日本初」といった表現の使用は難しくなっています。RCTジャパンは、長年の薬事コンサルティング実績を活かし、BSCGの認証プログラム「CERTIFIED DRUG FREE」を活用することで、この課題を解決するサービスを提供しています。
BSCG認証による「世界初」「日本初」のエビデンス
本サービスでは、BSCGの「CERTIFIED DRUG FREE」プログラムを利用し、製品を認証後、BSCGデータベースに登録することで、「世界初」(実質的に「日本初」)のエビデンスを取得できます。
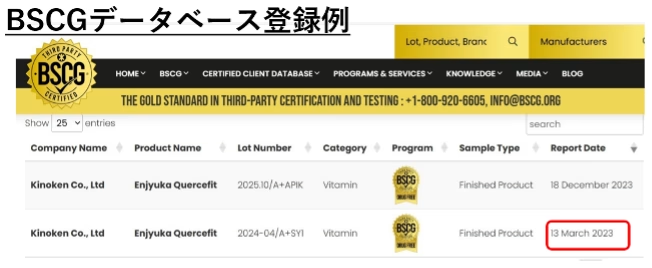
既に、機能性表示食品「延寿花 ケルセフィット」(機能性表示食品検定協会)が2023年3月にBSCGデータベースに登録されており、これがBSCG「CERTIFIED DRUG FREE」に初めて登録された機能性表示食品として、「世界初」「日本初」の広告表記に成功した事例となっています。
BSCG「CERTIFIED DRUG FREE」プログラムの詳細
BSCGは、オリンピック薬物検査のパイオニアであるドン・カトリン博士とその子息オリバー・カトリン氏によって2004年に設立された禁止薬物検査機関です。
「CERTIFIED DRUG FREE」プログラムは、WADA禁止成分298種類、BSCG規制薬物209種類を含む500種類以上の規制薬物を検査対象としています。有害な薬物汚染からユーザーを守る品質管理プログラムであり、包括的な薬物検査に加え、GMP(適正製造規範)、品質管理審査、原料・成分・サプライヤー審査、一般毒物アセスメントなども含まれています。検査はISO17025認定ラボで行われ、ロットごとの継続検査が求められます。
認証を受けた製品は、認証年月日とともにBSCGデータベースに登録されます。この登録が、「世界初」「日本初」を主張するためのエビデンスとなります。
さらに、本プログラムは500種類以上の医薬品成分、麻薬成分の検査も行っており、原料への医薬品成分の意図せぬ混入(コンタミネーション)の防止にも役立ちます。
原料コンタミネーション防止への活用
近年問題となっている、原料への医薬品成分のコンタミネーションも、原料の受け入れ時にBSCG検査を行うことで防止することが期待できます。BSCG検査対象成分には、漢方薬成分のエフェドリンなども含まれています。
BSCG認証取得までの流れ
- RCTジャパン指定の申込フォームへの記入と簡単な事前審査
- 入金確認後、試験検体(50g以上×2個)、原材料リスト、製造規格書の提出
- 1次スクリーニング:BSCGが指定する500以上の禁止成分の含有有無の検査(定量測定は行いません)
- BSCG検査機関への検体送付(送料はRCTジャパン負担)
- 分析結果報告と「世界初」タイトルの証明書発行、景品表示法対策のための広告表記アドバイス
注意事項
- 麻薬、覚せい剤、禁止薬物はお取り扱いできません。
- 要冷蔵、要保冷などの特殊商品、アメリカの輸入禁止製品はお取り扱いできません。
料金と納期
- 初期費用:150万円(初回ロット検査、審査、登録)(税別)
- 検査費用:ロットごとの検査が必要 60万円/回(税別)
- 登録費用:毎年1月更新 60万円/年(税別)
- 納期:検査品の当社への受け入れ後、約2ヶ月(繁忙期は3ヶ月)
株式会社RCTジャパンについて
2014年8月創業。東京都渋谷区に本社を置く薬事医療コンサルティング会社です。薬事コンサルティング、機能性表示食品の届出支援、セミナー・教育事業、健康食品・化粧品・医療機器の輸入販売などを事業としています。
お問い合わせ
株式会社RCTジャパン内 アンチドーピング・ドーピング・ジャパン 担当:持田 Mail: [email protected] TEL: 03-3400-3200
本サービスは、企業の製品広告における法的リスク軽減と、高品質な製品であることを消費者に明確に伝えるための有効な手段となるでしょう。
まとめ
2025年現在、株式会社RCTジャパンは、米国BSCGの認証プログラムを活用した、景品表示法に準拠した「世界初」「日本初」といった広告表記を可能にする品質認証サービスを提供しています。 このサービスは、製品の品質向上と信頼性向上に貢献し、企業のマーケティング活動を支援するものです。


コメント